Werking en functie van enzymen
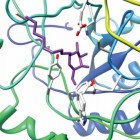 Bij lage temperaturen, zoals de lichaamstemperatuur, gaan chemische reacties (te) traag. In je lichaam zorgen dan enzymen (biokatalysatoren) ervoor dat die reacties toch snel genoeg verlopen. Dat doen ze door verlaging van de activeringsenergie, de minimale hoeveelheid energie die nodig is om een reactie te laten verlopen.
Bij lage temperaturen, zoals de lichaamstemperatuur, gaan chemische reacties (te) traag. In je lichaam zorgen dan enzymen (biokatalysatoren) ervoor dat die reacties toch snel genoeg verlopen. Dat doen ze door verlaging van de activeringsenergie, de minimale hoeveelheid energie die nodig is om een reactie te laten verlopen.
Enzymen
Enzymen binden zich aan het substraat (zo heten de om te zetten stof of stoffen). Door die binding ontstaan kleine wijzigingen in de substraatmoleculen, waardoor ze gemakkelijker reageren (splitsen of delen). Het enzym is daarna weer gewoon bruikbaar. Daarom is het ook belangrijk om de eiwitvorm niet te wijzigen. Wanneer de ruimtelijke vorm van het enzym verandert, past het substraat niet meer en gaat de enzymwerking verloren. Door de tertiaire structuur hebben ze namelijk een specifieke vorm en passen daarom maar op één substraat (substraatspecifiek).Reactiespecifieke enzymen
Daarnaast zijn enzymen reactiespecifiek. Dit wil zeggen dat ze maar één bepaalde reactie versnellen. Als enzym X de binding van de stoffen A en B katalyseert (versnelt), kan deze niet stof A met stof C binden (er zijn uitzonderingen op deze regel, maar dat is iets te diepgaand voor dit artikel). Deze kan namelijk niet goed passen in de structuur van het enzym, waardoor er geen binding plaatsvindt met het enzym en vervolgens met een andere stof. Het is ook mogelijk dat slechts één stof, stel stof D, in het enzym past en dit door het enzym in stoffen K en M gesplitst worden.Zuurgraad (pH) en temperatuur: effect enzymen
De pH en de temperatuur hebben ook een grote invloed op de werking van enzymen, omdat er in enzymen talloze zwakke bindingen zijn. Denk aan waterstofbruggen, ionverbindingen (gaan kapot bij hoge pH, waarover later meer) en sulfide-bindingen (breken bij hoge temperatuur). De eiwitten denatureren (raken beschadigd) als de bindingen niet meer in stand kunnen worden gehouden. Hierdoor raken ze hun structuur kwijt en kunnen ze niet meer hun oorspronkelijke taak vervullen. Dit heeft vooral betrekking op de eerder genoemde tertiaire structuur (zie ook het vorige leerdoel).Bufferwerking enzymen
Eiwitten (dus ook enzymen) reageren als een buffer: bij een lage pH nemen ze H+-ionen op, bij een hoge pH staan ze H+-ionen af. Zo verandert hun lading en daardoor de ruimtelijke structuur van de eiwitketen. De heeft direct gevolgen, zoals eerder gezegd, voor vorm en werking van enzymen. Voor elk enzym is er één pH waarbij dat enzym het beste werkt, dat wordt de optimum-pH genoemd. Dit is uit te zetten in een grafiek, de optimumkromme (deze lijkt op de klok van de normale verdeling in de kansrekening). Voor nucleïnezuren (RNA, DNA) geldt hetzelfde als de eiwitten, omdat ze ook een bepaalde vorm hebben die gevoelig is voor temperatuur en de zuurgraad.© 2008 - 2025 Victorho, het auteursrecht van dit artikel ligt bij de infoteur. Zonder toestemming is vermenigvuldiging verboden. Per 2021 gaat InfoNu verder als archief, artikelen worden nog maar beperkt geactualiseerd.
 Co-factoren en co-enzymenNaast het polypeptide gedeelte hebben veel enzymen ook nog een niet-proteïne component nodig om hun werking te kunnen ui…
Co-factoren en co-enzymenNaast het polypeptide gedeelte hebben veel enzymen ook nog een niet-proteïne component nodig om hun werking te kunnen ui…
 Spijsvertering van eiwit, vet en koolhydratenSpijsvertering van voedsel gebeurt met de hulp van enzymen. Uit eiwitten worden enzymen gemaakt door het lichaam zelf. E…
Spijsvertering van eiwit, vet en koolhydratenSpijsvertering van voedsel gebeurt met de hulp van enzymen. Uit eiwitten worden enzymen gemaakt door het lichaam zelf. E…
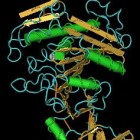 Het Lipase enzymHet lipase enzym komt voor in de alvleesklierenzym en splitst vetmoleculen tot een glycerolmolecuul en drie vetzuurmolec…
Het Lipase enzymHet lipase enzym komt voor in de alvleesklierenzym en splitst vetmoleculen tot een glycerolmolecuul en drie vetzuurmolec…
 Stofwisseling en verbrandingStofwisseling (metabolisme) en spijsvertering worden vaak door elkaar gehaald. Men denkt dat stofwisseling en spijsverte…
Stofwisseling en verbrandingStofwisseling (metabolisme) en spijsvertering worden vaak door elkaar gehaald. Men denkt dat stofwisseling en spijsverte…
 Poep is altijd hip!Drollen en keutels, je hebt ze in alle soorten en maten. Van microscopisch kleine uitwerpselen, tot aan reusachtige berg…
Poep is altijd hip!Drollen en keutels, je hebt ze in alle soorten en maten. Van microscopisch kleine uitwerpselen, tot aan reusachtige berg…
Gerelateerde artikelen
Kattengedrag: alleen goed opgevoede kittens!Ze ogen zo lief en knuffelen maar soms lijken ze al snel kleine verwende krengetjes. Ze gaan overal waar het niet mag, z…
Bronnen en referenties
- Inleidingsfoto: Libertas Academica, Flickr (CC BY-2.0)
- Nectar vwo bovenbouw, 2e fase, Wolters-Noordhoff, Groningen
Victorho (163 artikelen)
Laatste update: 23-09-2016
Rubriek: Dier en Natuur
Subrubriek: Biologie
Bronnen en referenties: 2
Laatste update: 23-09-2016
Rubriek: Dier en Natuur
Subrubriek: Biologie
Bronnen en referenties: 2
Per 2021 gaat InfoNu verder als archief. Het grote aanbod van artikelen blijft beschikbaar maar er worden geen nieuwe artikelen meer gepubliceerd en nog maar beperkt geactualiseerd, daardoor kunnen artikelen op bepaalde punten verouderd zijn. Reacties plaatsen bij artikelen is niet meer mogelijk.